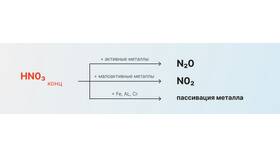
Азотная кислота (HNO₃) — сильный окислитель, требующий осторожного обращения при нейтрализации. Рассмотрим безопасные и эффективные способы ее обезвреживания.
Содержание
Основные методы нейтрализации
- Щелочная нейтрализация — наиболее распространенный способ
- Разбавление водой — для снижения концентрации
- Специальные абсорбенты — для небольших разливов
- Естественная деградация — для сильно разбавленных растворов
Щелочные нейтрализаторы для HNO₃
| Реагент | Реакция | Особенности |
| Гидроксид натрия (NaOH) | HNO₃ + NaOH → NaNO₃ + H₂O | Бурная экзотермическая реакция |
| Карбонат натрия (Na₂CO₃) | 2HNO₃ + Na₂CO₃ → 2NaNO₃ + H₂O + CO₂ | Менее интенсивное выделение тепла |
| Гидроксид кальция (Ca(OH)₂) | 2HNO₃ + Ca(OH)₂ → Ca(NO₃)₂ + 2H₂O | Образуется малорастворимый осадок |
Порядок безопасной нейтрализации
- Надеть средства индивидуальной защиты (очки, перчатки, халат)
- Разбавить кислоту холодной водой (если высокая концентрация)
- Медленно добавлять нейтрализующий агент при постоянном перемешивании
- Контролировать температуру и pH раствора
- Довести pH до 6-8 (нейтральная среда)
- Утилизировать нейтрализованный раствор согласно нормативам
Меры предосторожности
- Работать в вытяжном шкафу или хорошо проветриваемом помещении
- Избегать контакта с органическими веществами (возможен взрыв)
- Не использовать аммиак для нейтрализации (образует взрывоопасные нитраты)
- Охлаждать реакционную смесь при сильном нагреве
- Иметь доступ к воде для промывки в случае попадания на кожу
Утилизация продуктов нейтрализации
- Нитраты металлов можно утилизировать как неопасные отходы
- Концентрированные растворы требуют специальной утилизации
- Не допускать попадания в водоемы и почву
- Соблюдать местные экологические нормативы
Правильная нейтрализация азотной кислоты требует строгого соблюдения техники безопасности и экологических норм. Для промышленных объемов рекомендуется использовать автоматизированные системы нейтрализации.